Das Glioblastom ist als WHO Grad 4 Tumor klassifiziert und gehört zu den aggressivsten Tumoren mit einer 10 Jahres Überlebensrate von 0,71%1. Das Glioblastom ist der häufigste bösartige hirneigene Tumor bei Erwachsenen und zeigt die schlechteste 5 Jahres Überlebensrate von allen beim Mensch vorhandenen Tumorarten2.
Es handelt sich hierbei um einen Tumor welcher von den Gliazellen des Gehirns ausgehen und eine infiltrative Wachstumsart zeigt. Die Grundpfeiler der Therapie eines Glioblastoms liegen in der operativen Resektion, Bestrahlung und Chemotherapie.
Glioblastome können im Gehirn an allen Stellen auftreten, zeigen sich jedoch besonders häufig supratentoriell gelegen und nur äußerst selten infratentoriell. Prinzipiell unterscheidet man zwischen primären Glioblastomen und sekundären Glioblastomen. Das primäre Glioblastom entwickelt sich direkt aus den Gliazellen, wohingegen das sekundäre Glioblastom sich aus einem niedriggradigem Gliom heraus entwickelt.
Epidemiologie
In den USA lag die Inzidenzrate bei 3,19 pro 100.000 Personen mit einem Durchschnittsalter von 64 Jahren und kommt bei Männern etwa 1,6 mal häufiger vor als bei Frauen3. Die Zahlen in Europa zeigen sich etwa vergleichbar mit jenen der USA. Bei Kindern und Jugendlichen sind Glioblastome eine Seltenheit, können jedoch in dieser Altersklasse ebenso auftreten. Das Durchschnittsalter bei Kindern für ein supratentoriell gelegenes Glioblastom liegt bei 12,7 Jahren und bei Glioblastomen im Hirnstamm bei 6,7 Jahren4.

Symptome
Die Symptome welche zu einer Erstdiagnos des Glioblastoms führen zeigen sich sehr unterschiedlich. Hierbei kann es beispielsweise zu Wesensveränderungen kommen, welche durch Angehörige bemerkt werden. Eine Studie aus 1957 zeigte anhand 219 Patienten in allen Altersklassen die Häufigsten Symptome, durch welche die Patientin symptomatisch geworden sind5, wobei sich Kopfschmerzen als häufigstes Symptom zeigten.
Symptomhäufigkeit
| Symptom | Vorhanden in (%) | Initiales Symptom in (%) | Hauptbeschwerde in (%) |
|---|---|---|---|
| Kopfschmerzen | 86 | 37 | 35 |
| Mentale Veränderung | 47 | 7 | 3 |
| Übelkeit, Erbrechen | 45 | 0 | 1 |
| Motorisches Defizit | 44 | 3 | 5 |
| Visuelle Beeinträchtigung | 39 | 5 | 2 |
| Beeinträchtiges Bewusstsein | 39 | 3 | 7 |
| Gangstörung | 35 | 2 | 0 |
| Hirnnervendefizit | 35 | 4 | 1 |
| Persönlichkeitsveränderung | 34 | 7 | 1 |
| Krampfanfälle | 32 | 16 | 10 |
| Aphasie | 32 | 5 | 4 |
| Sensorische Beeinträchtigung | 23 | 4 | 1 |
| Tabelle adaptiert von Frankel et al.6 |
Diagnose
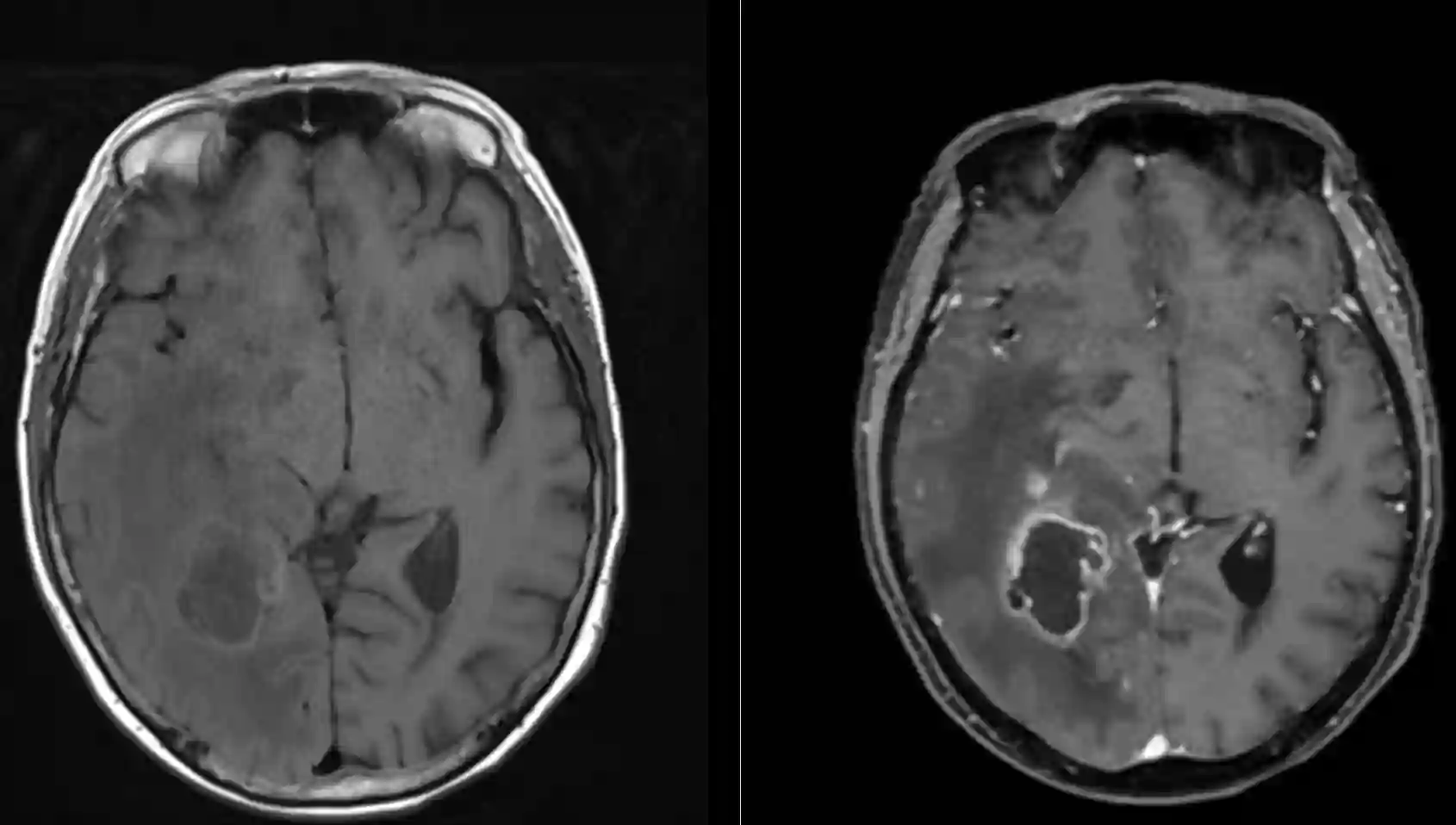
Die Diagnose eines Glioblastoms kann nur anhand einer Gewebeprobe erfolgen. Bildgebend kann die Diagnose nicht sicher gestellt werden, da bildgebend differentialdiagnostisch oft ein Lymphom nicht ausgeschlossen werden kann. Der Goldstandard in der Bildgebung ist das MRI, welches auch zur Planung des operativen Vorgehens notwendig ist. Im MRI zeigt sich ein Glioblastom typischerweise in der nativen T1 Sequenz als hypo- oder isointense Masse, welche in den Kontrastmittelsequenzen variabel, insbesondere am Rand, Kontrastmittel aufnimmt. Die Kontrastmittelaufnahme zeigt sich meistens am Rand des nekrotischen Gewebes.

Resektion vs. Biopsie
Die Diagnosestelleung eines Glioblastoms kann nur mittels histopathologischer Verifzierung erfolgen. Wenn möglich sollte eine operative Therapie angeboten werden, da dies nachweislich das Überleben der Patienten verbessert.
Die Hauptargumente gegen eine operative Resektion ist ein schlechter Karnofsky-Index, stark vorangeschrittenes Alter des Patienten oder eine eloquente Lage des Tumors7.
Operative Resektion
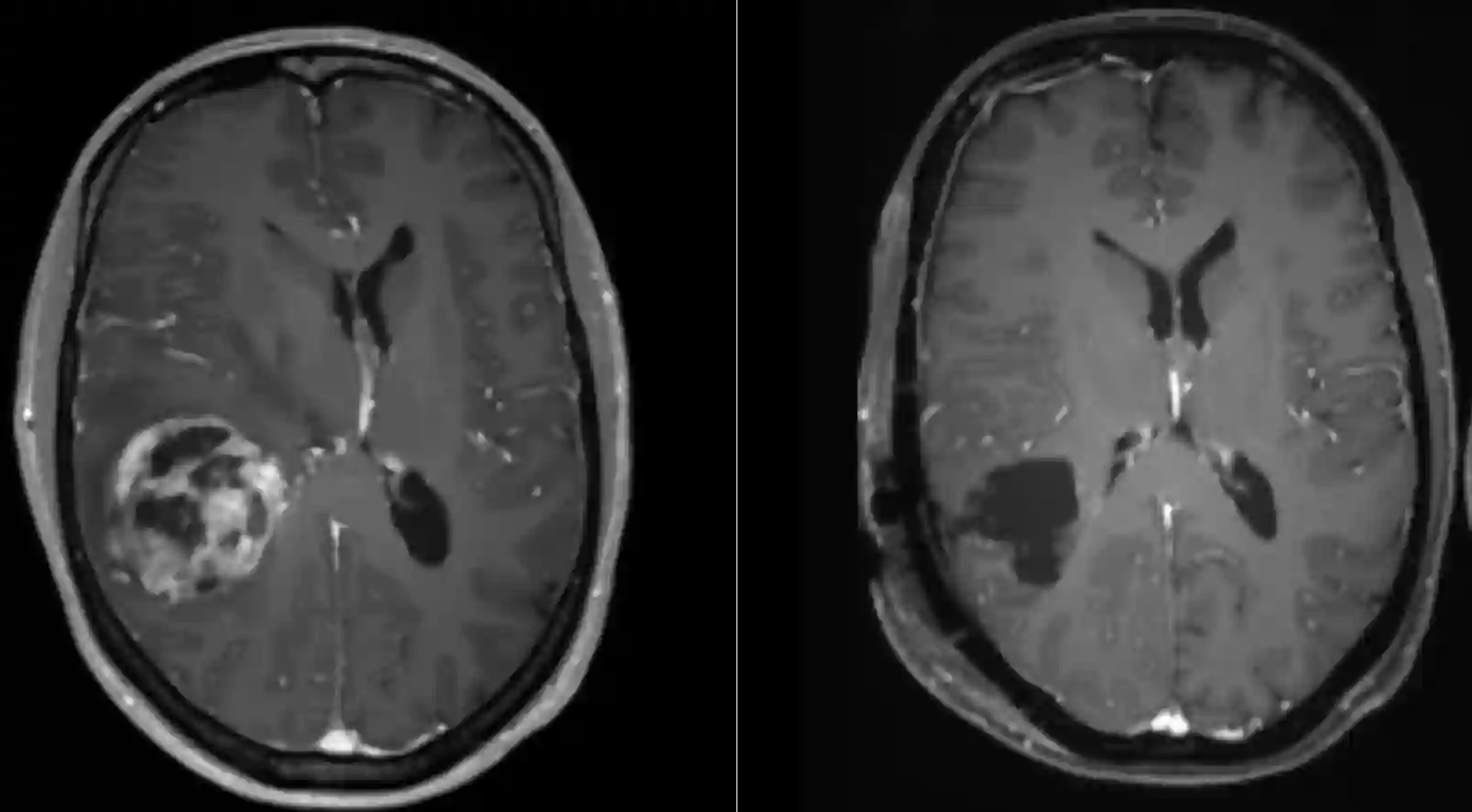
Die operative Resektion eines Glioblastoms sollte immer eine vollständige Resektion des Kontrastmittelaufnehmenden Tumoranteils als Ziel haben. Eine vollständige Resektion des Kontrastmittelaufnehmenden Anteil des Glioblastoms (CRET ist mit einer höheren Überlebensrate assoziiert8. Um das Ausmaß der chirurgischen Resektion zu beurteilen wird innerhalb der ersten 48 Stunden nach der Operation üblicherweise ein erneutes MRI durchgeführt um dies zu beurteilen. Eine Verzögerung dieser postoperativen Bildgebung kann dazu führen, dass nicht mehr sicher zwischen postoperativen Blutauflagerungen und Tumorgewebe unterschieden werden kann, daher sollte die Bildgebung innerhalb von 48 Stunden nach der Operation durchgeführt werden.

Biopsie
Das Ziel einer Biopsie ist die Sicherung der Diagnose, ohne jedoch dabei relevant Tumorgewebe zu entfernen. Eine Biopsie sollte bei Patienten in Erwägung gezogen werden, bei denen eine operative Resektion nicht sinnvoll oder nicht möglich ist. Durch eine gesicherte Diagnose eines Glioblastoms ist es möglich ein Therapiekonzept mittels Radiochemotherapie zu etablieren ohne eine Tumorresektion durchzuführen.
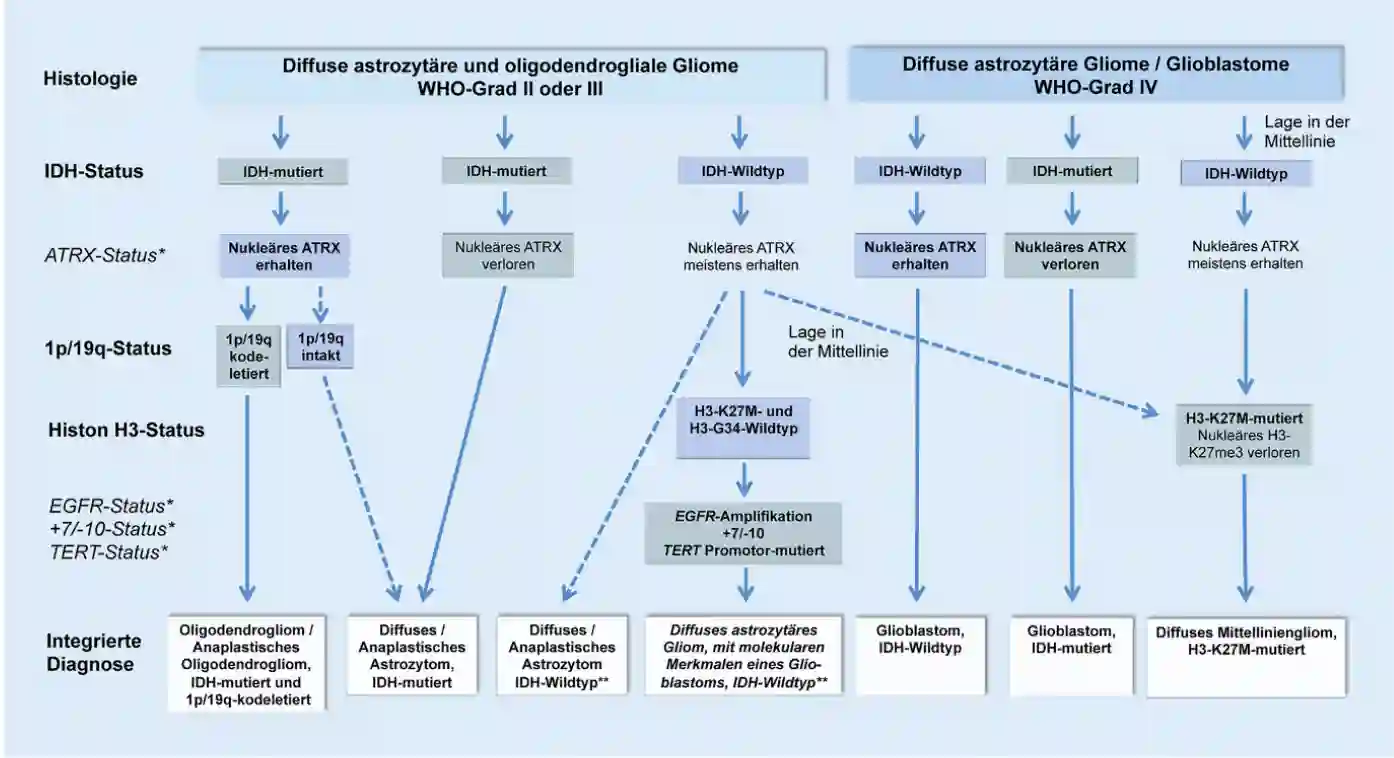
Klassifikation
Die aktuelle Einteilung von Glioblastomen erfolgt nach der WHO Klassifikation von 20169, in welcher das Glioblastom als Grad 4 klassifiziert wird. Die Einteilung erfolgt nach der WHO Klassifikation von 2016 nach histopathologischen Merkmalen als auch anhand von definierten molekulargenetischen Markern. Aktuell werden vier diagnostische Biomarker verwendet10:

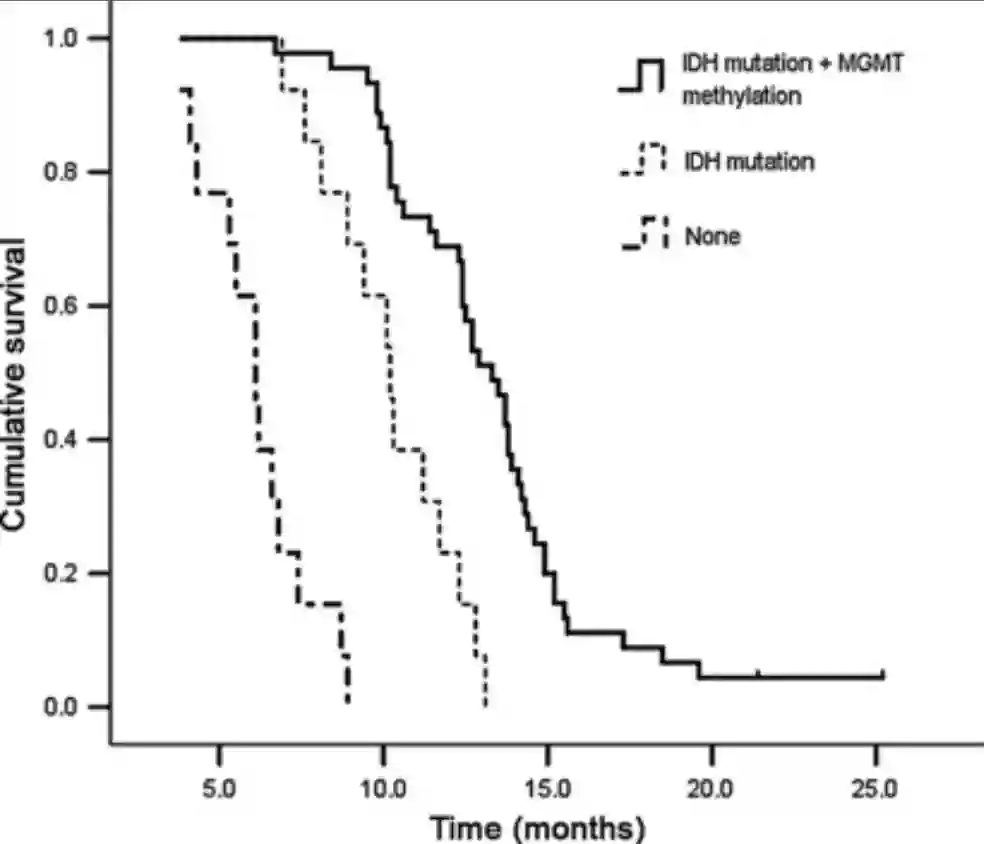
IDH1/2
Die Isocitrat-Dehydrogenase (IDH) ist ein Enzym, welches für den Zitratzyklus notwendig ist. Besteht eine Mutation im IDH1/2 Gen, so besteht ein Überlebensvorteil gegenüber der Wildtyp Variante. IDH Mutationen finden sich besonders häufig bei Patienten mit einem sekundären Glioblastom11.

Postoperative Behandlung
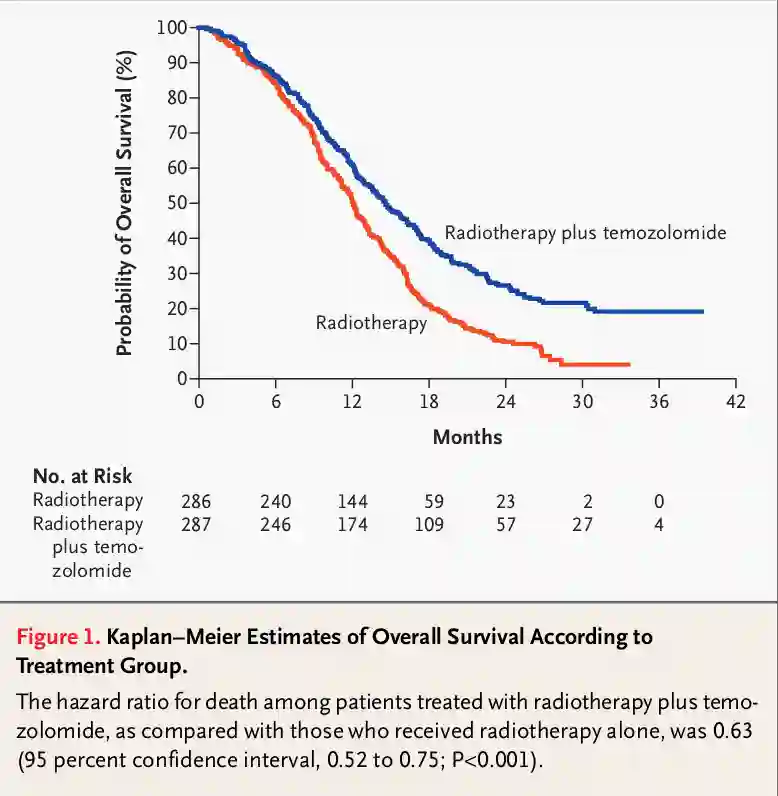
Die etablierte Behandlung nach Diagnose und Resektion eines Glioblastoms ist das so genannte Stupp Schema, welches nach dem Schweizer Mediziner Roger Stupp benannt ist. Es handelt sich hierbei um eine kombinierte Radiochemotherapie. Das Stupp Protokoll sieht eine fraktionierte Radiotherapie von insgesamt 60 Gy aufgeteilt auf 2 Gy über 5 Tage für 6 Wochen mit gleichzeitiger Gabe von 75mg Temozolomid pro Quadratmeter Körperoberfläche pro Tag vor. Nach abgeschlossener Radiotherapie erfolgen 6 Zyklen Chemotherapie mit Temozolomid in einer Dosierung von 150-200mg pro Quadratmeter Körperoberfläche über 5 Tage in einem 28 Tageszyklus12. Patienten welche mit einer kombinierten Radiochemotherapie behandelt werden zeigten ein klinisch relevanten und statistisch signifikanten Überlebensvorteil gegenüber Patienten mit einer reinen Radiotherapie13.

Corticosteroide in der Behandlung von Glioblastomen
Corticosteroide wie beispielsweise Dexamethason finden einen häufigen Einsatz in der Behandlung von Glioblastomen. Tumore wie Glioblastome verursachen häufig ein vasogenes Hirnödem, welche einen raumfordernden Effekt und somit zu einer neurologischen Verschlechterung der Patienten führen kann. Corticosteroide zeigen bei einem vasogenen Hirnödem ein sehr effektiven antiödematösen Effekt14. Der Einsatz von Dexamethason sollte jedoch gut indiziert sein, da neuer Daten daraufhin deuten, dass der Einsatz von Dexamethason zwar eine kurzzeitige Besserung der Symptome bedingt durch eine Reduktion des Ödems bringt, jedoch wahrscheinlich einen negativen Effekt auf die Resultate der Bestrahlung haben könnte15.
Rezidiv
Bei einem Glioblastomrezidiv tritt dieses im Regelfall an der Stelle der primären Lokalisierung. In weniger als 10% der Fälle kommt es zu einem Rezidiv an einer anderen Stelle als der ursprünglichen Lokalisierung16. Je nach klinischen Zustand und Ausprägung und Lokalisierung des Rezidivs kann eine erneute chirurgische Resektion in Erwägung gezogen werden.
Überlebenszeit
Die Überlebenszeit bei Patienten mit einem Glioblastom ist trotz moderner Medizin äußerst schlecht. Patienten ohne Behandlung haben ein durchschnittliches Überleben von 3 Monaten17.
Studien konnten zeigen, dass bei einer 80%igen Tumorresektion die insgesamte Überlebenszeit der Patienten sich erhöht. Das Überleben erhöht sich schrittweise bei einer weiteren Tumorresektion zwischen 80-100%18 19 20.
Referenzen
Tykocki, Tomasz, and Mohamed Eltayeb. "Ten-year survival in glioblastoma. A systematic review." Journal of Clinical Neuroscience 54 (2018): 7-13. ↩ ↩ ↩ ↩
Krex, Dietmar, et al. "Long-term survival with glioblastoma multiforme." Brain 130.10 (2007): 2596-2606. ↩ ↩ ↩ ↩
Tamimi, Ahmad Faleh, and Malik Juweid. "Epidemiology and outcome of glioblastoma." Exon Publications (2017): 143-153. ↩ ↩ ↩ ↩
Dohrmann, George J., Jacqueline R. Farwell, and John T. Flannery. "Glioblastoma multiforme in children." Journal of neurosurgery 44.4 (1976): 442-448. ↩ ↩ ↩ ↩
Frankel, Saul A., and William J. German. "Glioblastoma multiforme: review of 219 cases with regard to natural history, pathology, diagnostic methods, and treatment." Journal of neurosurgery 15.5 (1958): 489-503. ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩
Taylor A, Karajannis MA, Harter DH. Glioblastoma multiforme: State of art and future therapeutics. Surg Neurol Int. 2014;5:64 ↩ ↩ ↩ ↩
Bloch, Orin, et al. "Impact of extent of resection for recurrent glioblastoma on overall survival." Journal of neurosurgery 117.6 (2012): 1032-1038. ↩ ↩ ↩ ↩
Komori T. The 2016 WHO Classification of Tumours of the Central Nervous System: The Major Points of Revision. Neurol Med Chir (Tokyo). 2017;57(7):301-311. ↩ ↩ ↩ ↩
Alexandrescu S, Korshunov A, Lai SH, Dabiri S, Patil S, Li R, Shih CS, Bonnin JM, Baker JA, Du E, Scharnhorst DW, Samuel D, Ellison DW, Perry A (2016) Epithelioid Glioblastomas and Anaplastic Epithelioid Pleomorphic Xanthoastrocytomas same entity or first cousins? Brain Pathol 26(2):215–223 ↩ ↩ ↩ ↩
SongTao, Qi, et al. "IDH mutations predict longer survival and response to temozolomide in secondary glioblastoma." Cancer science 103.2 (2012): 269-273. ↩ ↩ ↩ ↩
Stupp, Roger, et al. "Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma." New England journal of medicine 352.10 (2005): 987-996. ↩ ↩ ↩ ↩ ↩ ↩ ↩ ↩
Reulen, Hans J., Alexander Hadjidimos, and Kurt Schürmann. "The effect of dexamethasone on water and electrolyte content and on rCBF in perifocal brain edema in man." Steroids and brain edema. Springer, Berlin, Heidelberg, 1972. 239-252. ↩ ↩ ↩ ↩
Pitter, Kenneth L., et al. "Corticosteroids compromise survival in glioblastoma." Brain 139.5 (2016): 1458-1471. ↩ ↩ ↩ ↩
Choucair AK, Levin VA, Gutin PH, et al. Development of Multiple Lesions During Radiation Therapy and Chemotherapy. J Neurosurg. 1986;65:654-658. ↩ ↩ ↩ ↩
Malmostrom A, Gronberg BH, Marosi C, Stupp R, Frappaz D, Schultz H, et al. Temozolamide versus standard 6-week radiotherapy versus hypo fractionates radiotherapy in patients older than 60 years with glioblastoma. The Nordic randomized phase 3 trial. Lancet Oncol. 2012;13:916–26. ↩ ↩ ↩ ↩
Li, Yan Michael, et al. "The influence of maximum safe resection of glioblastoma on survival in 1229 patients: can we do better than gross-total resection?." Journal of neurosurgery 124.4 (2016): 977-988. ↩ ↩ ↩ ↩
Sanai, Nader, et al. "An extent of resection threshold for newly diagnosed glioblastomas." Journal of neurosurgery 115.1 (2011): 3-8 ↩ ↩ ↩ ↩
Stummer, Walter, et al. "Fluorescence-guided surgery with 5-aminolevulinic acid for resection of malignant glioma: a randomised controlled multicentre phase III trial." The lancet oncology 7.5 (2006): 392-401. ↩ ↩ ↩ ↩